HHOガスの特徴は
HHOガスは温度が発火点になると自発的に燃焼する。
酸素と水素が1:2 の混合ガス(水素爆鳴気)は、常圧において発火点が約570°Cとなる。
そのような混合気体へ着火するのに必要なスパークの最小エネルギーは、約20マイクロジュールールである。 
常温常圧では、水素が体積の4%から95%を占めている場合、HHO ガスは燃焼可能である。
ひとたび着火すると、この混合気体は発熱反 応により水蒸気へと変わり、その発熱によって反応が持続する。
1モルの水素の燃焼につき241.8kJのエネルギー(低発熱量)を発生する。
発生する熱エネルギーの量は燃焼の形式に影響されないが、炎の温度は変化する。
酸素と水素の組成を正確に調整すると炎は最高で約 2800°Cとなり、大気中で水素ガスを燃やしたときより700 °C 高い。
混合比率が 2:1でない場合や、窒素のような不活性気体が混ざって いる場合、熱がより大きな体積へ拡散するため、温度が低くなる。
化石燃料には気体燃料と液体燃料が有り、気体燃料ではメタン(CH4)を主成分とする天然ガスからプロパンガスやブタンガス類があり、中 でもメタンが主成分の天然ガスは水素分子が多く含まれており、先述の反応燃焼から元々燃焼効率がよく相対的にCO2発生も少ない燃料で あり、HHOガスの助燃効果は、より効率的に燃焼します。
また、液体燃料の石油系燃料は、炭素の鎖状連結しており、炭素(C)の数に対 し水素(H) は少なく燃焼時に送り込まれた空気中の酸素は水素と先に燃焼反応を起こし、炭素は燃焼しないまま放出されたり不完全燃焼ガ スとして放出されるため、燃焼効率がよくありません。
そこへ HHOガスを送り込むことによって、水素の燃焼反応が先に起こり、 炭素の燃焼を誘引し完全燃焼化に近づけるため飛躍的に燃焼効率を高めることが可能になるのです。
又、燃焼時、油は小さな分子に熱分解されますから、そこに水素を添加すれば、炭素などの排出を抑えることができるのです。
化石燃料は、C(炭素)とH(水素)の組み合わせであり、Cが鎖状に連鎖すればするほどO(酸素)との反応が不十分になる。
また、水素の反応速度は炭素の反応速度より十数倍速いので空気を多く入れても不完全燃焼が起こりやすくなります。
これに人工的に安定したHHOガスを混ぜれば、化石燃料の完全燃焼化になり、水素の高い燃焼カロリーが有効に使 われるため、省エネ効果を得られることになります。
天然ガスはCH4(メタンガス)が主成分であるため、液体化石燃料に 比べれば省エネ効果少ないですが、それでも水素燃料の供給と同じなので効果は期待できます。
CO₂排出量・燃料消費量削減シュミレーション(A)
HHOガスを燃料に混合させることにより次の効果が認められます。
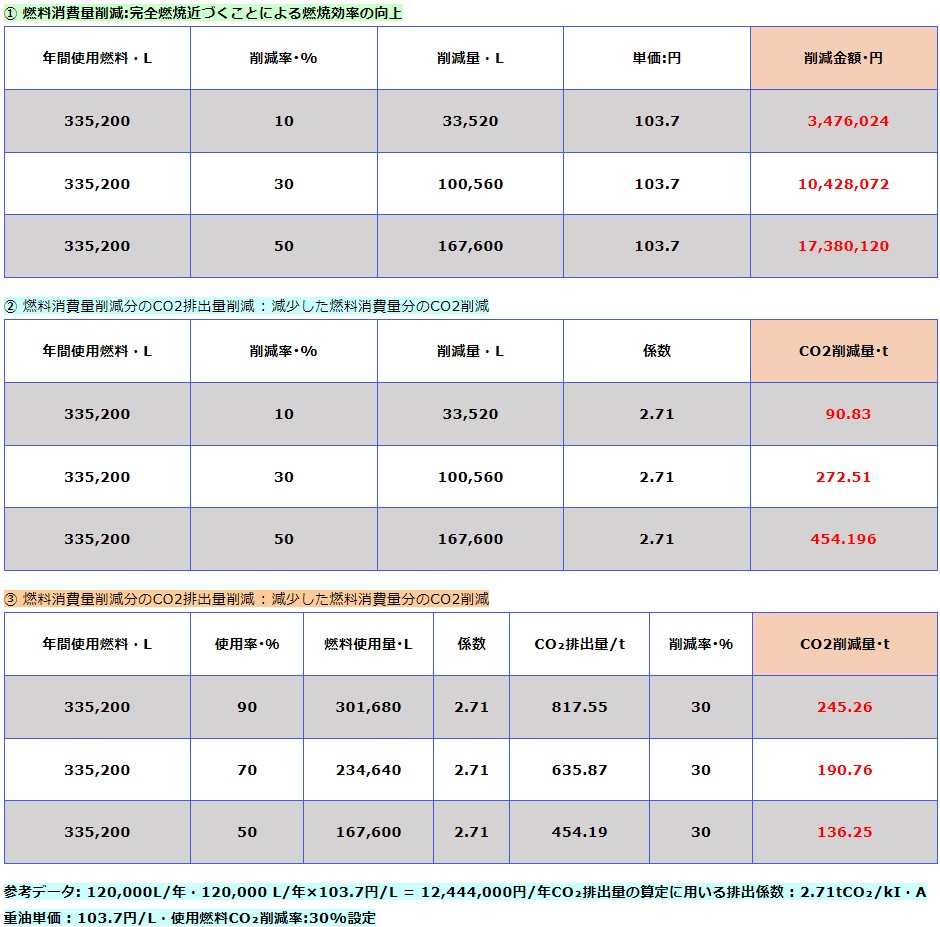
参考データ: 120,000L/年・120,000 L/年×103.7円/L = 12,444,000円/年
CO₂排出量の算定に用いる排出係数 : 2.71tCO₂/kI・A重油単価 : 103.7円/L・使用燃料CO₂削減率:30%設定
CO₂排出量・燃料消費量削減シュミレーション(B)
HHOガスを燃料に混合させることにより次の効果が認められます。
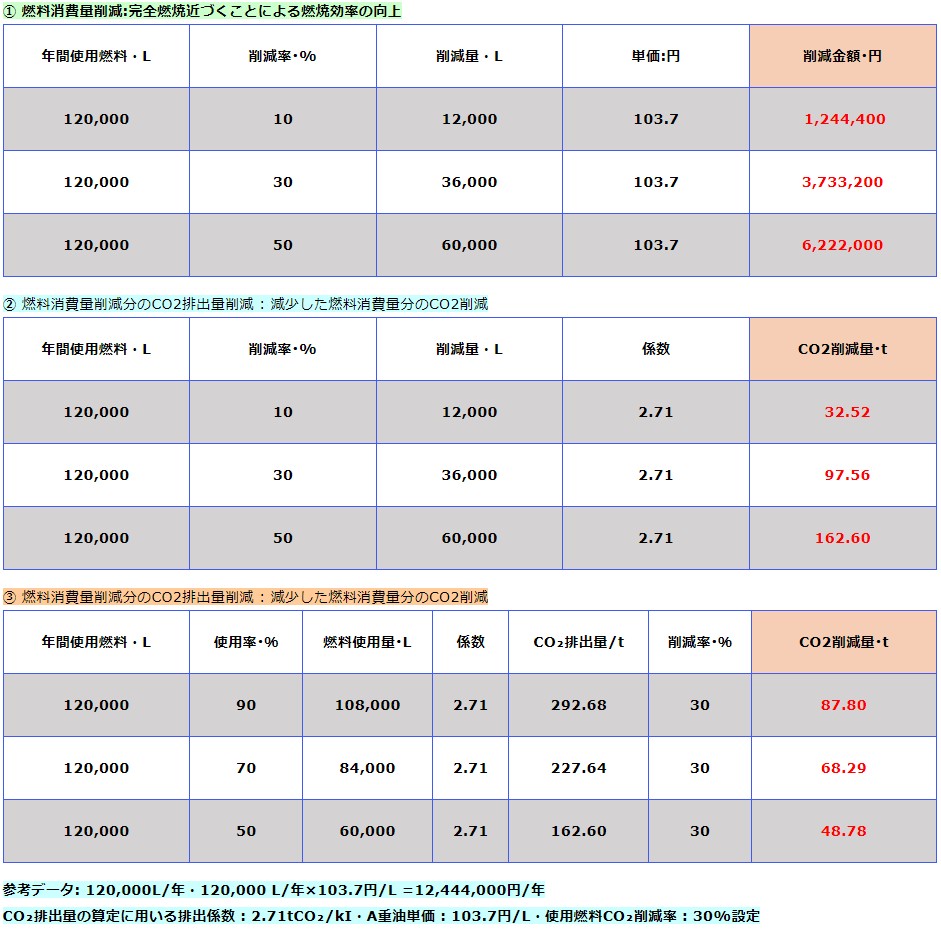
参考データ: 120,000L/年・120,000 L/年×103.7円/L =12,444,000円/年
CO₂排出量の算定に用いる排出係数 : 2.71tCO₂/kI・A重油単価 : 103.7円/L・使用燃料CO₂削減率 : 3


